
뷰웍스가 자사의 슬라이드 스캐너 신제품 ‘VISQUE DPS(Digital Pathology System) LH510’이 유럽 체외진단의료기기 인증인 ‘CE IVDR’의 획득을 완료했다고 29일 밝혔다. 이로써 EU 권역 내에서 신제품 판매 및 유통이 가능해져 디지털 병리진단의 핵심 시장인 유럽을 본격 공략할 수 있게 됐다. VISQUE DPS 신제품은 2022년 5월 새로운 체외진단의료기기 규정 시행으로 까다로워진 요건을 모두 통과함으로써 제품 기술력과 신뢰도 높은 운영 시스템을 모두 인정받았다. 기존 대비 ▲기술문서 요건 강화 ▲임상 성능 평가서 필수화 ▲시판 후 감시보고 필수화 등 항목이 추가됐다. 이에 뷰웍스는 실제 임상 성능 평가를 진행해 제품 유효성을 확보하고 제품의 사후 품질관리 체계까지 입증했다. 이번 인증을 토대로 뷰웍스는 국내와 북미에 이어 유럽 시장에서 바이오 신사업 확대에 적극 나서 관련 점유율을 끌어올릴 것으로 기대하고 있다. 최근 뷰웍스는 국내 주요 대형병원 도입 이후 필드 테스트를 진행하고 있으며 지난 3월 미국 보스턴에서 열린 북미 병리학회 학술 전시 ‘USCAP Annual Meeting 2025’를 통해 신제품을 북미 시장에

식품의약품안전처는 소프트웨어 제품을 의료기기 또는 체외진단의료기기로 분류하는 명확한 기준을 마련하고, 해당 기준에 따라 의료기기로 재분류 되었지만 현재 의료기기 소분류가 마련돼 있지 않은 전립선·간·당뇨·폐 질환 위험평가 소프트웨어 등 4개 품목을 '맞춤형 신속 분류' 품목으로 지정한다고 2일 밝혔다. 맞춤형 신속 분류란 신개발 등 새로운 제품의 경우 분류 결정 등에 장시간이 소요됨을 고려해 한시품목으로 우선 분류함으로써 신속한 개발과 제품화를 지원하는 것을 말한다. 그간 소프트웨어 제품별로 검토해 의료기기 또는 체외진단의료기기로 분류해 왔으나, 새로운 유형의 다양한 소프트웨어 제품이 다수 개발되고 있어 의료기기·체외진단의료기기 소프트웨어에 대한 허가·심사의 일관성을 유지하고 투명성과 신뢰성을 높이기 위해 이번 분류 기준을 마련했다고 식약처는 전했다. 분류 기준은 해당 소프트웨어 제품에 입력하는 임상정보 값을 제공하는 기기가 의료기기인 경우 의료기기로, 체외진단의료기기인 경우 체외진단의료기기로 분류하되, 의료기기와 체외진단의료기기로 측정한 임상정보 값 모두를 입력하는 제품은 의료기기로 분류한다. 이번에 마련된 분류 기준에 따라 의료기기와 체외진단의료기기가 측
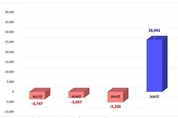
코로나 진단검사 품목 지속 성장 힘입어…2년 연속 흑자 기록 지난 2020년 처음으로 흑자를 달성한 의료기기 무역수지가 지난해에도 전년 대비 약 44% 상승한 3조 7489억원을 기록했다. 식품의약품안전처는 3일 우리나라 의료기기가 코로나19 진단검사 관련 품목의 지속적인 성장세 등에 힘입어 이같이 2년 연속 흑자를 달성했다고 밝혔다. 지난해 의료기기 생산 실적은 12조 8831억원으로 2020년 대비 27.1% 증가했다. 수출 실적은 9조 8746억원, 수입 실적은 6조 1257억원으로 각각 2020년 대비 30.0.%와 20.8% 상승했다. 한편 지난해 국내 의료기기 시장규모는 9조 1341억원으로 2020년 대비 21.3% 증가하는 등 지난 5년 동안 시장규모는 연평균 10.2%의 성장세를 이어가고 있다. 지난해 의료기기 생산·수입·수출 실적의 주요 특징은 ▲체외진단의료기기 생산·수출 지속 성장 ▲코로나19 사전검사 자가진단분야 급성장 ▲개인 건강과 관련된 제품 성장세다. 먼저 전체 의료기기 생산 실적 중 지난해 체외진단의료기기 생산 실적은 33.8%를 차지하며 의료기기 무역수지 성장을 이끌었는데, 2020년 대비 29.7% 증가한 약 4조 3501억원